
新闻活动 新闻动态
肺纤维化是一种进展性致死疾病,患者呼吸困难、肺功能持续衰退。尽管小干扰RNA(siRNA)疗法能够在分子层面“关掉”致病信号,但肺部浓稠黏液与细胞屏障阻止了核酸药物的有效递送,使疗效大打折扣。
近日,西湖大学遗传物质表达与重构全国重点实验室王怀民团队在 Science Advances 发表研究论文,报道了一种核小体启发的多肽递送平台(MNM),该系统能同时穿越肺黏液层、细胞膜和内体屏障,实现靶向递送抗纤维化siRNA,显著改善动物模型的肺纤维化症状,为肺部基因治疗开辟了新的方向。
理学院博士研究生孔楠、陈鼎灏为文章共同一作,西湖大学特聘研究员王怀民为文章通讯作者。

一、设计理念:让多肽学会打包与突围
在自然界中,核小体是生命信息的最小组织单元——它不仅打包DNA,更以结构和动力学决定了基因何时被读取。受到这种“分子打包智慧”的启发,科研团队思考:如果材料也能像核小体一样,被编程、能识别、会调控,那么,复杂的生物屏障是否也能被重新定义?基于这种来自生命底层逻辑的材料设计思路,研究团队受到核小体DNA打包结构的启发,设计和筛选出一种具有组蛋白仿生结合域、黏液穿透多肽片段与穿膜模块的多肽分子,命名为MNM。MNM 能像组蛋白一样高效地压缩并保护siRNA,在生物环境中自组装成粒径约 80 nm 的纳米颗粒,同时保持轻微正电,使其既能与细胞膜结合,又不被带负电的黏液网“困住”。
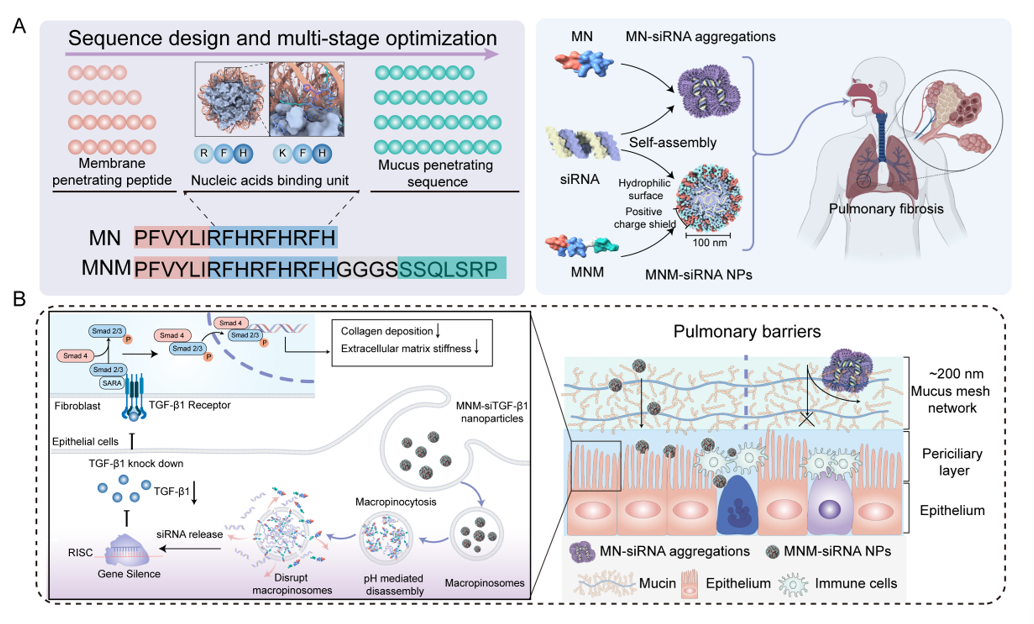
图1. 多肽载体MNM设计策略和跨屏障机制示意图
二、MNM纳米颗粒的三步“突围之旅”
1. 雾化吸入后穿越黏液层快速扩散;
2. 与细胞膜结合并经巨胞饮进入细胞;
3. 在酸性内体中结构重排、释放siRNA至胞质,从而抑制 TGF-β1 表达,阻断纤维化进程。
三、穿透黏液与细胞屏障:让基因药物真正“进得去”
雾化吸入给药后,MNM/siRNA 纳米颗粒能够快速穿过肺部黏液层并分布于气道与肺泡区域。与传统阳离子载体相比,MNM 系统的肺内滞留时间更长、覆盖范围更广。细胞实验和成像分析表明:MNM 主要通过巨胞饮(macropinocytosis)进入肺上皮细胞,并能在酸性环境中自发解离、逃逸内体包裹,将 siRNA 高效释放到胞质中。
四、功能验证:siTGF-β1 有效逆转纤维化进程
研究者选取纤维化关键因子 TGF-β1 作为靶点,构建 MNM-siTGF-β1 纳米药。在博来霉素诱导的肺纤维化小鼠模型中,该体系显著降低了 TGF-β/Smad 信号通路活性,减少胶原沉积与炎症反应,恢复肺顺应性与气体交换能力,小鼠生存率明显提高。更重要的是,该纳米药可冻干保存、耐雾化喷射,在长期给药下未观察到明显毒性或免疫反应,显示出优异的生物安全性与转化潜力。
五、可编程的“核酸递送乐高平台”
MNM 平台不仅能精准递送 siRNA,还可拓展用于 mRNA、circRNA 及其他核酸药物。通过序列模块化设计与多肽工程化优化,这一“核小体启发”的小车策略为未来的肺部基因疗法与智能生物材料设计提供了新思路。
这项研究展示了如何从“生命的打包智慧”中汲取灵感,从生命的底层逻辑出发,展示了“仿生命”材料如何重构分子运输与疾病干预的新模式。让基因疗法真正突破肺部屏障。
王怀民课题组研究领域
王怀民课题组主要运用材料化学、化学生物学、细胞/分子生物学等开发设计新型生物功能材料,化学生物学工具、活细胞原位标记和反应等。课题组负责人目前主持国家优青等多个科研项目,为理学院生物材料实验室负责人,同时兼任工学院生物医学工程领域研究员。
招聘信息
课题组在如下领域招聘博士后及相关科研人员:
生物材料、高分子化学、抗菌材料、水凝胶、肿瘤与免疫相关、神经生物学、基因编辑等
联系方式
课题组网站:
https://www.hm-wanglab.com/
















