
新闻活动 新闻动态
骨质疏松症是老龄化社会面临的重大健康挑战,尤其在绝经后女性群体中高发,其特征是骨吸收过度导致骨密度下降、骨折风险显著升高。目前一线治疗药物如双膦酸盐虽能抑制骨吸收,却无法区分“好”与“坏”的破骨细胞,容易干扰正常骨重建过程,甚至引发下颌骨坏死、非典型股骨骨折等严重并发症。因此,开发一种能精准清除病理性破骨细胞、同时促进骨形成的新型疗法,成为骨质疏松治疗领域的迫切需求。
近日,西湖大学王怀民研究员团队在Nature Communications上发表题为“Bone homeostasis regulation by in vivo generation of osteoclast-derived apoptotic bodies using targeted self-assembly”研究论文。基于该团队在溶酶体稳态调控方面的积累,结合骨质疏松疾病的分子机制,从头设计了一种名为 OsteoSAVE(亦称BGD) 的自组装多肽体系,该系统可在体内选择性靶向成熟破骨细胞并进入到溶酶体,进而破坏溶酶体稳态,诱导成熟破骨细胞凋亡,其凋亡过程中产生的凋亡小体促进骨形成,从而实现“破骨清除-成骨再生”的双重治疗目标,实现骨质疏松症的治疗。
西湖大学博士后章鹏与博士研究生陈鼎灏为文章第一作者,西湖大学化学系副教授王怀民为文章通讯作者。

论文地址:https://www.nature.com/articles/s41467-025-66791-9
精准设计的模块化纳米治疗系统
研究团队采用“模块化设计”理念,构建了OsteoSAVE多肽纳米颗粒系统。该系统包含三大功能模块(图1):
1. 自组装核心模块(Bip-FFWKYK):基于联苯基与苯丙氨酸的π-π堆积作用,可在特定条件下自组装形成纳米纤维结构;
2. 酶响应触发模块(GHPG↓GPQ):包含组织蛋白酶K(CTSK)特异性切割位点,该酶在成熟破骨细胞中高表达,而在破骨前体细胞中活性极低;
3. 骨靶向与递送模块(DDDDDD):天冬氨酸序列赋予纳米颗粒强大的骨靶向能力,同时表面负电荷特性使其被破骨细胞优先摄取。
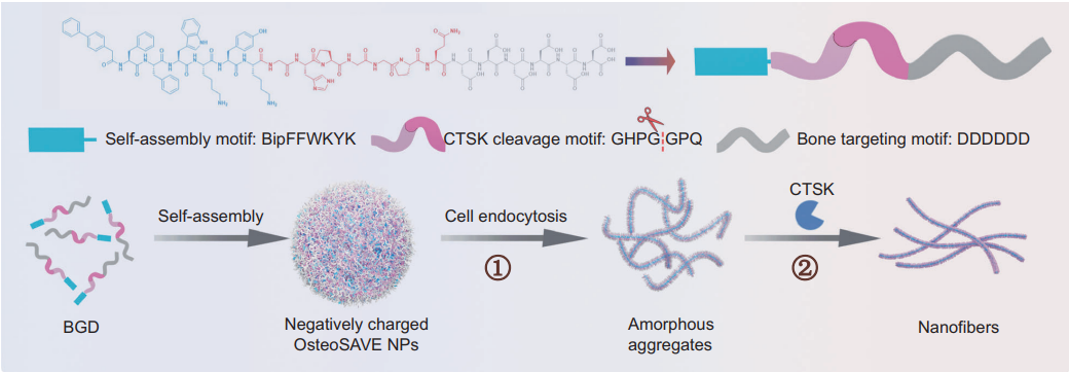
图1. OsteoSAVE纳米颗粒的模块化设计示意图
三步治疗机制详解
第一步:智能识别与靶向蓄积
经静脉注射后,OsteoSAVE纳米颗粒凭借其骨靶向序列迅速富集于骨组织表面。由于其表面带有负电荷,主要被具有强大吞噬能力的成熟破骨细胞摄取,而被其他细胞类型摄取极少,实现了细胞选择性。
第二步:酶触发自组装与精准清除
OsteoSAVE被破骨细胞吞噬进入溶酶体后,CTSK酶特异性切割连接肽段,触发构象改变,自组装成纳米纤维破坏溶酶体膜完整性,导致酶泄漏和细胞凋亡。该过程仅针对高表达CTSK的成熟破骨细胞,而CTSK表达极低的破骨前体细胞几乎不受影响。
第三步:凋亡小体作为“再生信使”
破骨细胞凋亡过程中产生大量凋亡小体(Apoptotic Bodies, ABs)。蛋白质组学分析显示,OsteoSAVE诱导产生的凋亡小体富含血小板衍生生长因子-BB(PDGF-BB),其含量显著高于传统药物阿仑膦酸钠(ALD)诱导产生的凋亡小体。当这些凋亡小体被骨髓间充质干细胞(BMSCs)摄取后,可显著激活 PI3K/AKT信号通路,促进成骨相关基因(ALP、Runx2)表达,促进骨再生。
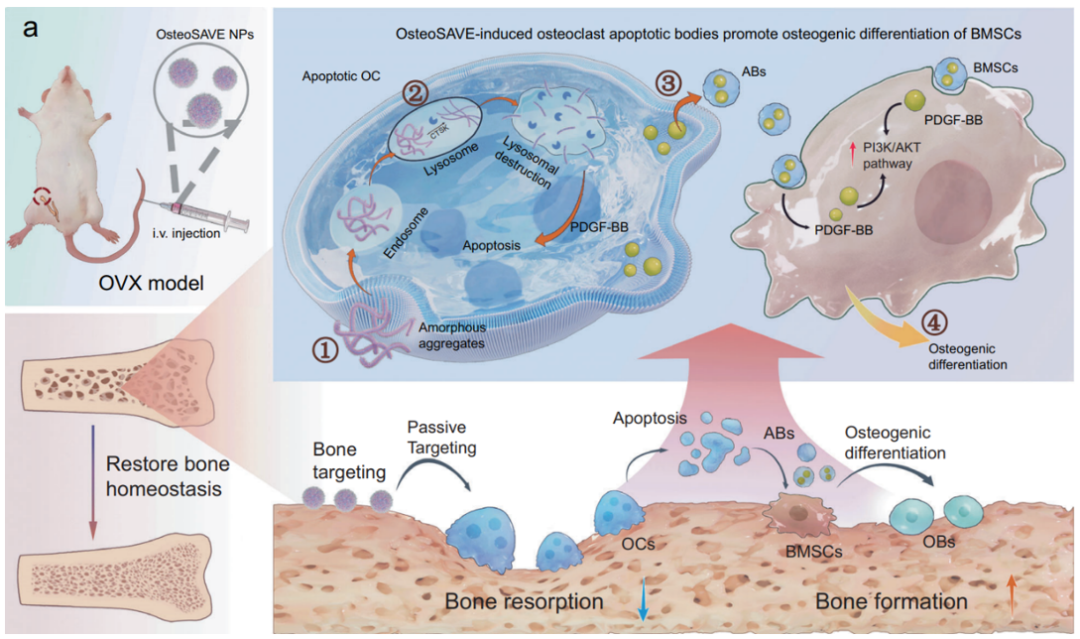
图2. OsteoSAVE纳米颗粒的治疗机制流程示意图
(从左至右:骨靶向→破骨细胞摄取→CTSK触发自组装→溶酶体破坏→细胞凋亡→凋亡小体释放→BMSC摄取→成骨分化)
BGD的酶响应特性及生物学功能
为了评估BGD的酶响应性性能,在BGD中添加CTSK(800 ng/mL)后,BGD发生酶切并自组装形成纳米纤维。液相色谱-质谱联用(LC-MS)分析显示,完整BGD逐渐降解,并出现与酶切产物Bip-FFWKYKGHPG对应的特征峰,酶切半衰期为2.29小时。
为了评估BGD对由BMMs和RAW264.7细胞分化形成的破骨细胞的作用及选择性,作者在RANKL诱导的第5天加入多肽进行干预。TRAP染色及细胞毒性实验表明,与RANKL对照组相比,BGD能浓度依赖性地减少破骨细胞数量。相比之下,对照肽BAD对破骨细胞数量无显著影响,提示CTSK响应性对选择性诱导破骨细胞死亡具有关键作用。预先使用CTSK抑制剂Balicatib处理可显著减弱BGD对破骨细胞的抑制作用,证实CTSK介导的酶切是BGD发挥活性的必要条件。为进一步评估BGD对破骨细胞介导的骨吸收的影响,作者进行了细胞骨架F-actin荧光染色以及牛骨吸收实验。F-actin荧光染色显示,与RANKL组及Balicatib预处理组相比,BGD处理组的破骨细胞F-actin范围显著减小,表明其功能受损。牛骨片的扫描电子显微镜观察显示,BGD组的骨吸收面积显著小于RANKL组。
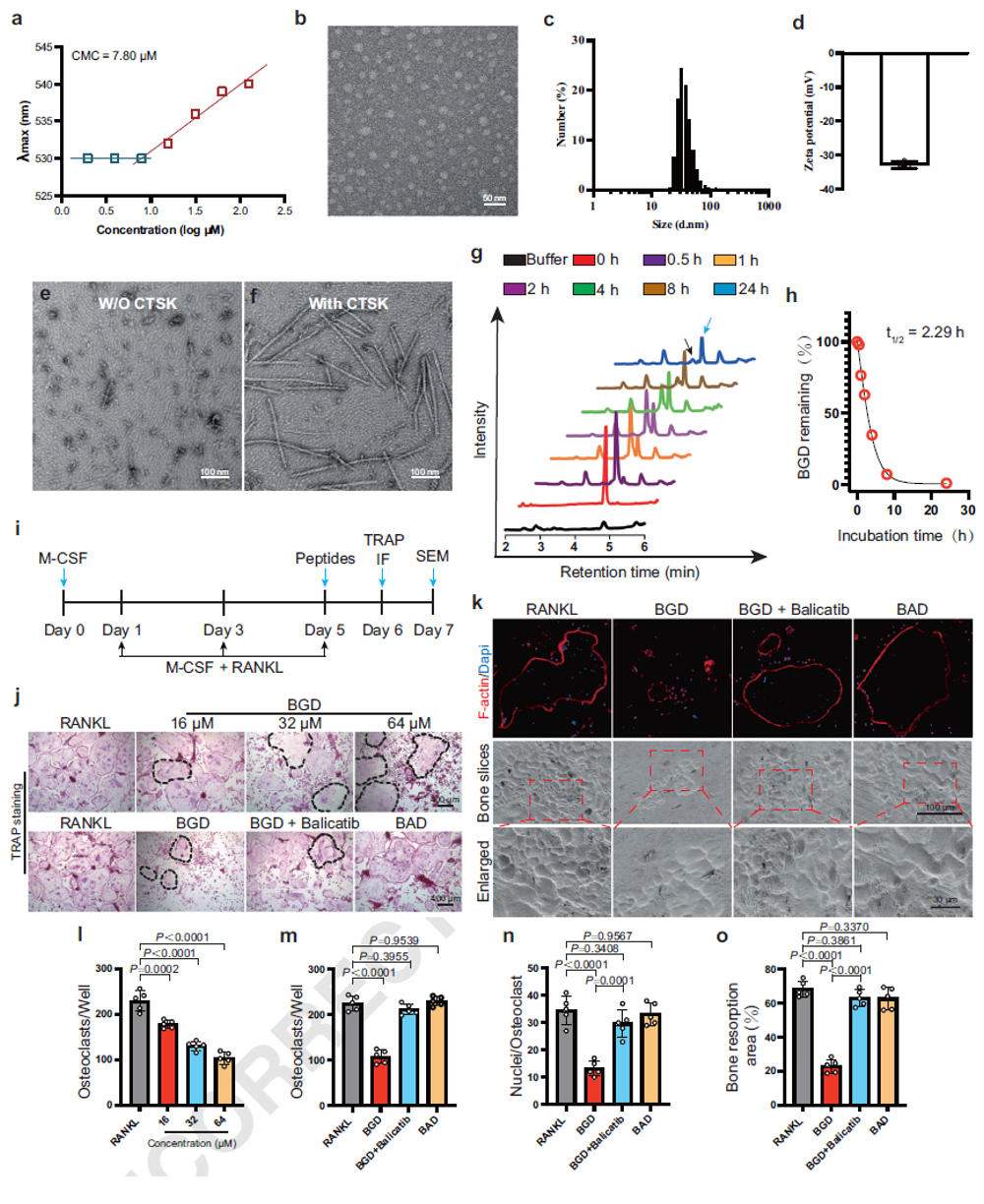
图3. BGD的酶响应特性及其生物学功能
BGD通过溶酶体自组装诱导OC凋亡
为阐明BGD诱导破骨细胞死亡的机制,作者进行了一系列实验。免疫荧光成像显示,经BGD-Cy5.5处理24小时后,破骨细胞在细胞培养板及牛骨片上的伪足环结构均遭到破坏,细胞逐渐解体。为探究破骨细胞对纳米颗粒的内吞机制,作者采用多种内吞抑制剂进行共孵育实验,结果提示BGD通过多种内吞途径被破骨细胞摄取。而上述BGD的作用均可被CTSK抑制剂Balicatib预处理所逆转,证实了CTSK在BGD活性中的关键作用。为进一步评估BGD对溶酶体的影响,利用溶酶体膜标志物Lamp1及溶酶体酶CTSK进行免疫荧光实验。RANKL组中Lamp1与CTSK信号共定位明显,而BGD干预24小时后,两者共定位程度降低,破骨细胞呈现解体和分裂迹象。生物电镜直观揭示了BGD被破骨细胞内吞的动态过程,可观察到BGD组装形貌发生改变,最后组装成纳米纤维破坏溶酶体。此外,作者观察到BGD主要诱导破骨细胞发生凋亡(红色荧光),而坏死信号(绿色荧光)极弱。Tunel染色与Western blot结果进一步验证了凋亡过程。
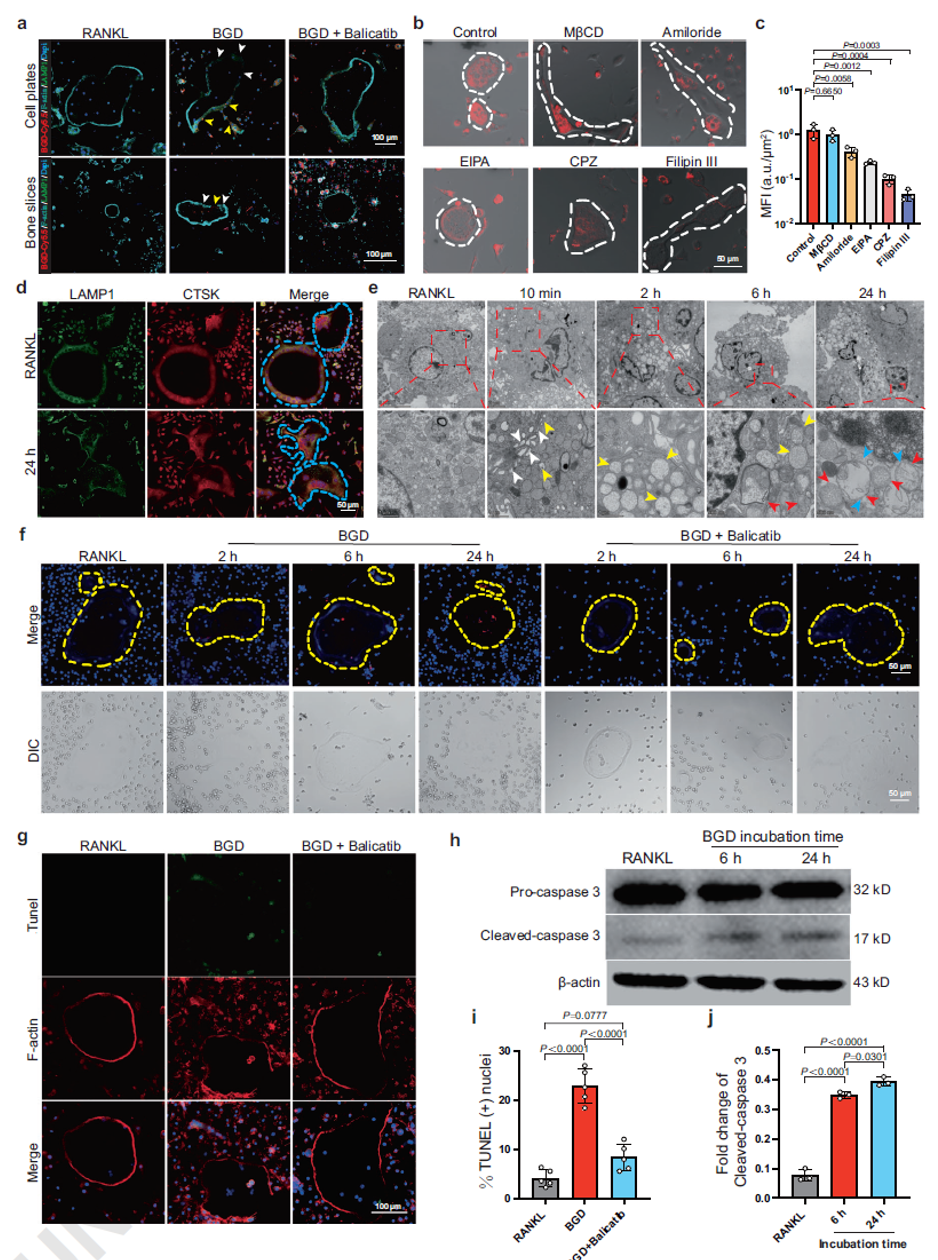
图4. BGD自组装破坏溶酶体并诱导OC中的凋亡
BGD诱导产生的破骨细胞凋亡小体(ABs)通过激活PI3K/AKT信号通路促进骨髓间充质干细胞(BMSCs)的成骨分化
作者为探究不同来源的破骨细胞ABs的生物学功能,作者同时收集了BGD与阳性对照药物阿仑膦酸钠(ALD)诱导产生的ABs,并检测其对BMSCs成骨分化的影响。通过共聚焦显微镜观察、透射电镜、动态光散射分析、流式细胞术检测证实,BGD-ABs与ALD-ABs均为球形单膜囊泡,直径分布在700 nm至5 μm之间。
为进一步解析BGD-ABs与ALD-ABs的蛋白质组组成,作者进行了LC-MS/MS分析。结果显示,PDGF-BB被鉴定为BGD-ABs的关键组分,而在ALD-ABs中其表达量较低。差异蛋白主要富集于代谢通路、PI3K-Akt信号通路及氧化磷酸化等通路。
为验证凋亡小体在成骨分化中的作用,作者将BGD-ABs与BMSCs共培养,显示BMSCs对ABs的摄取呈时间依赖性。通过染色与Western blot证实,BGD-ABs与ALD-ABs均能诱导成骨分化,且BGD-ABs的成骨潜能更高,这一差异可能归因于BGD-ABs中更高的PDGF-BB含量。此外,BGD-ABs能显著激活PI3K/AKT通路。
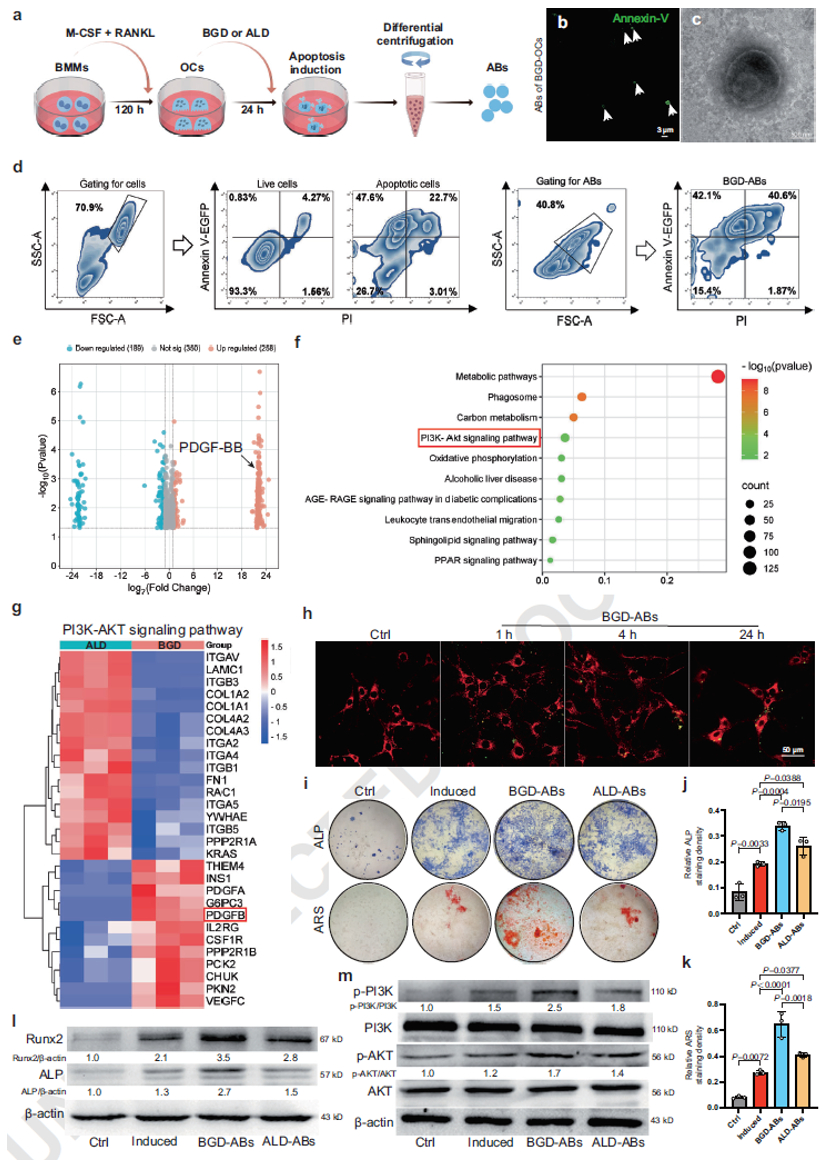
图5. BGD-ABs激活PI3K/AKT信号通路促进BMSCs成骨分化
BGD的体内骨靶向与抗骨质疏松效应
为探究BGD纳米颗粒的骨靶向性和生物分布,作者在卵巢切除(OVX)术后28天的小鼠模型中静脉注射Cy5.5标记的BGD和BGG。IVIS成像分析显示BGD具有强大的骨靶向能力。股骨切片的免疫荧光共染实验进一步确认了BGD的骨靶向特异性。
为评估BGD的治疗潜力,Micro-CT成像显示,与OVX组和BGG组相比,BGD和ALD能显著改善骨显微参数,且BGD在所有参数的改善情况上均优于ALD,表明其在延缓骨量丢失方面具有更优疗效。股骨切片的H&E和TRAP染色进一步证实了上述结果。
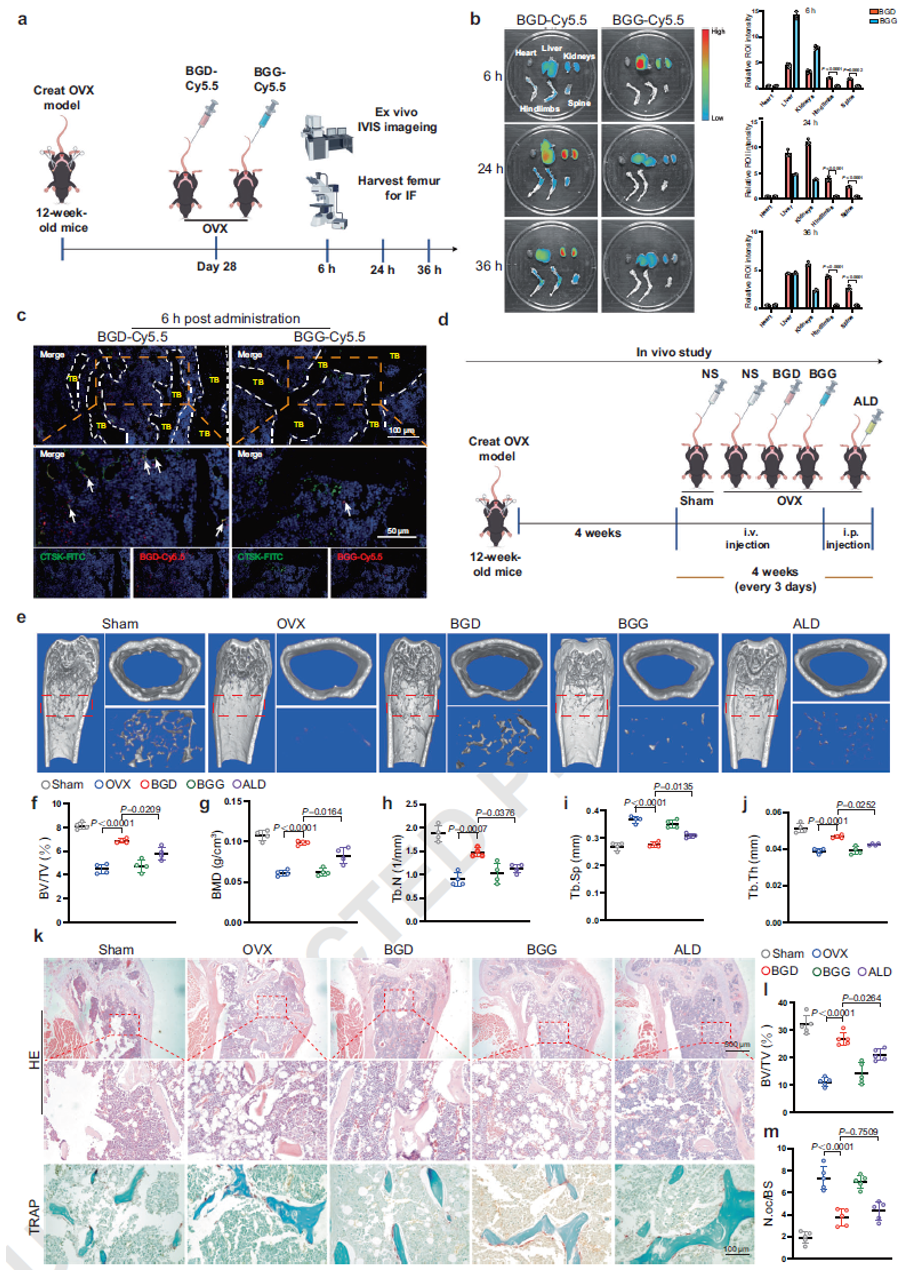
图6. BGD的骨靶向性与抗骨质疏松效应
BGD促进体内骨形成
为探究BGD在体内对骨稳态的调控作用,作者在卵巢切除(OVX)术后第5周对小鼠分别给予BGD、BGG及ALD治疗。通过茜素红/钙荧光染色双标、Von kossa、Masson等实验证实,与OVX组、BGG组及ALD组相比,BGD组骨形成能力显著增强。免疫组化染色表明,BGD组中磷酸化AKT(p-AKT)、Runx2、ALP及VEGF的阳性表达最强,提示其同时激活了成骨与血管耦联系统。相比之下,BGD组中破骨细胞活性标志物CTSK的表达水平最低,表明骨吸收过程受到显著抑制。
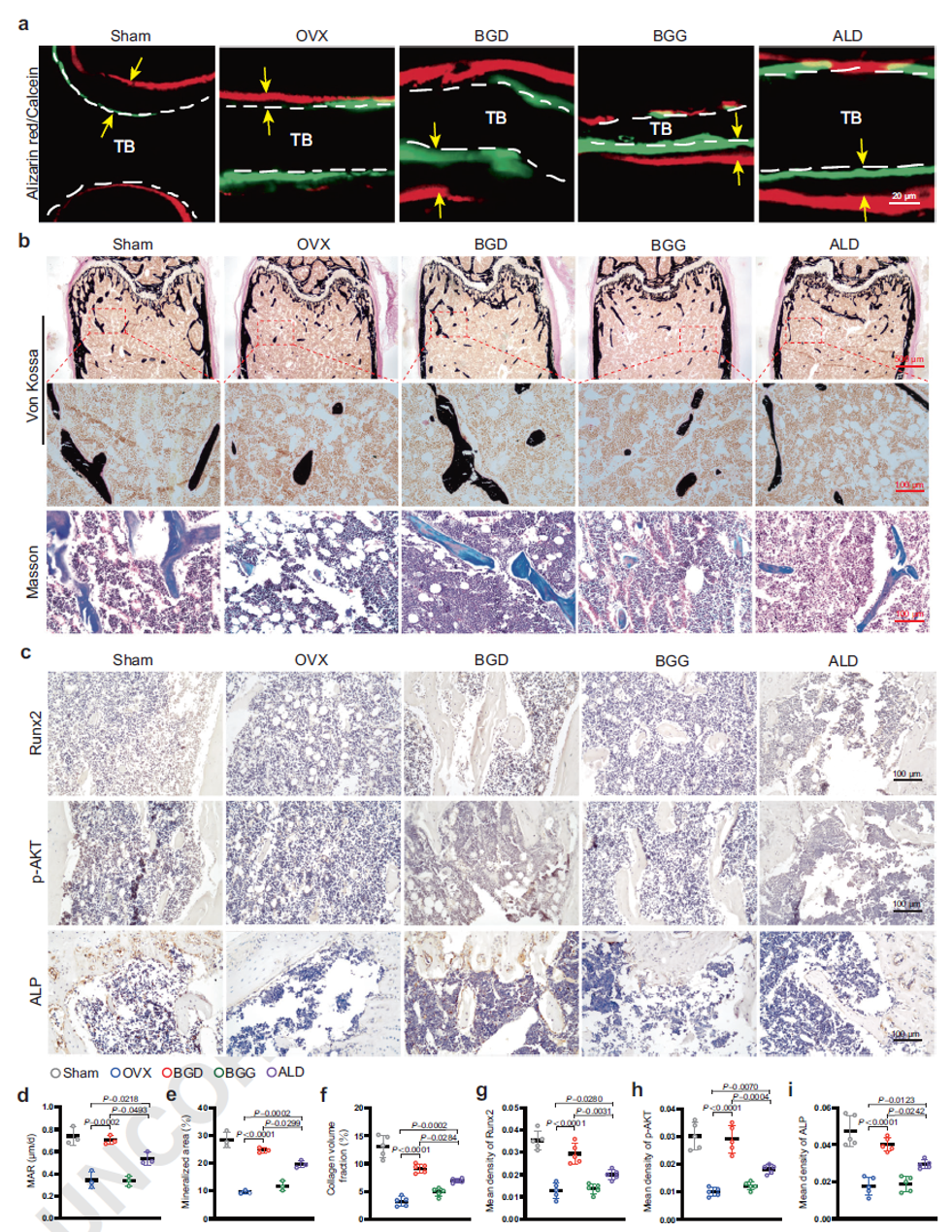
图7. BGD促进体内骨形成
小结
总之,研究团队通过分子设计、自组装调控与细胞信号重塑,成功构建了一种能够智能识别病理性破骨细胞、同步启动骨再生程序的纳米治疗系统。这项研究标志着骨质疏松治疗从“单纯抑制”向“精准调控与再生修复”转变的重要一步,也为下一代生物材料与递送系统的开发提供了新范式。该研究得到了国家自然基金,西湖大学相关基金的支持。
王怀民课题组研究领域
王怀民课题组主要运用材料化学、化学生物学、细胞/分子生物学等开发设计新型生物功能材料,化学生物学工具、活细胞原位标记和反应等。课题组负责人目前主持国家优青等多个科研项目,为理学院生物材料实验室负责人,同时兼任工学院生物医学工程领域研究员。
招聘信息
课题组在如下领域招聘博士后及相关科研人员:
生物材料、高分子化学、抗菌材料、水凝胶、肿瘤与免疫相关、神经生物学、基因编辑等
联系方式
课题组网站:
https://www.hm-wanglab.com/
















